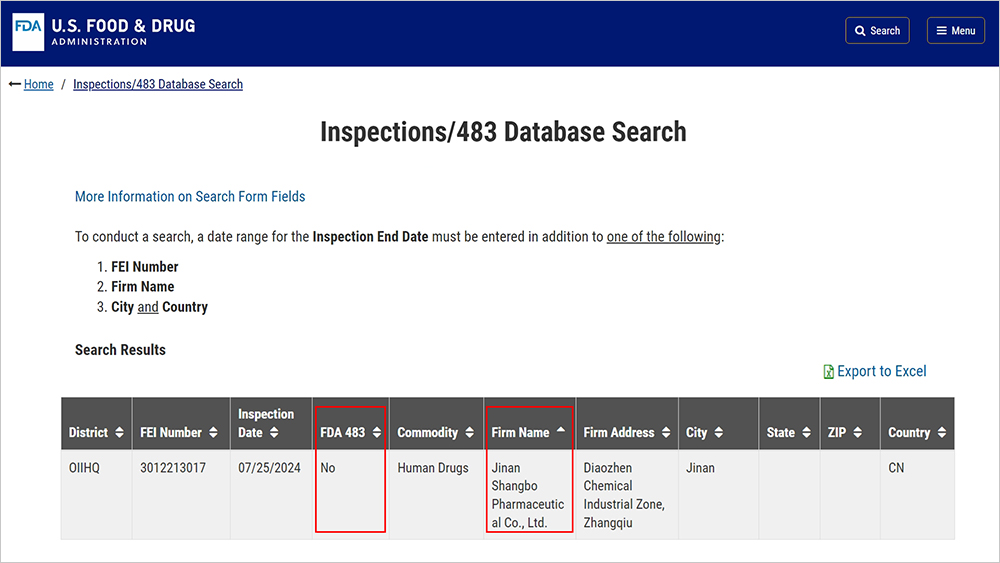
2024年7月,美国FDA对尚博医药进行了为期4天的cGMP现场检查,此次检查涉及非无菌原料药瑞美吉泮中间体的生产制造,检查范围涵盖质量、实验室、生产、设施与设备、物料、包装和标签等系统。公司先进的生产设施、质量管控及专业素养极高的团队,给审查人员留下深刻印象。
2024年10月26日,尚博医药正式收到山东省药品监督管理局签发的《药品生产许可证》(D证)。此次为尚博首次申请药品生产许可证核发,申请核发品种为原料药(阿昔莫司)。


多年来,尚博医药秉承着“以人为本,客户至上”的经营理念,始终将产品质量放在首位,建立健全了稳定的质量运行机制和质量保证体系,培养出一支高素质、专业化的生产和管理团队,不断提升生产效率和产品质量,以专业技能与优质服务赢得客户信赖。未来,尚博医药将继续坚守高标准的生产质量管理,不断创新研发,为推动全球医药行业高质量发展贡献智慧和力量。

